糖尿病伤口长期难以愈合,主要归因于其病理性微环境,包括高糖状态、过度氧化应激以及晚期糖基化终末产物(AGEs)的积累等。该微环境易导致细菌感染、持续慢性炎症、血管与神经生成受阻以及细胞外基质重塑障碍,从而严重影响愈合进程。如何设计多功能材料,使其能够按需清除细菌,同时调节炎症微环境、促进血管神经再生及细胞外基质重塑,对于推动糖尿病患者伤口愈合极为关键。
针对上述问题,近日,熟女俱乐部
金属材料强度全国重点实验室的研究人员构建了一种核壳型双金属纳米酶((Cu@Ce)HM),其内核为铜键合的铈基金属有机框架(Cu@Ce-MOF),外壳为负载抗菌肽HHC36的透明质酸(HA)。在感染的糖尿病微环境中,(Cu@Ce)HM 可响应性释放铜离子与HHC36,二者协同发挥优异的广谱抗菌作用,对金黄色葡萄球菌和大肠杆菌的抗菌率分别达到97.01%和99.55%。铜的键合引起Ce-MOF内部电子重排,形成Cu⁺/Cu²⁺与Ce³⁺/Ce⁴⁺氧化还原对,进而增强其模拟超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性,有效清除活性氧(ROS),改善糖尿病病理微环境。微环境的改善与低剂量铜离子共同促进巨噬细胞由M1型向M2型转化,增强抗炎细胞因子的分泌,从而进一步提升内皮细胞(HUVECs)、神经细胞(PC12)和成纤维细胞(L929)的生物学功能,促进伤口部位的血管神经再生及细胞外基质重塑。转录组测序分析显示,(Cu@Ce)HM 通过其抗氧化特性与铜补充作用,上调关键信号通路—包括PI3K/Akt/CREB、Ras/ERK/CREB和Ras/ERK/MAPK,从而促进受损PC12细胞的修复与分化。
这相工作针对糖尿病感染伤口提出了一种具有应用潜力的“全阶段”管理策略,集成感染控制、免疫调节以及促进神经血管生成与细胞外基质(ECM)重塑于一体,为糖尿病感染伤口的治疗提供了新思路。该成果以《核壳结构的双金属纳米酶Cu@Ce-MOF搭载抗菌肽实现糖尿病感染伤口愈合全阶段管理》(A bimetallic catalyst core-shell nanoplatform enabling all-stage management of infected diabetic wound healing)为题发表于生物材料领域顶级期刊《生物材料》(Biomaterials)。
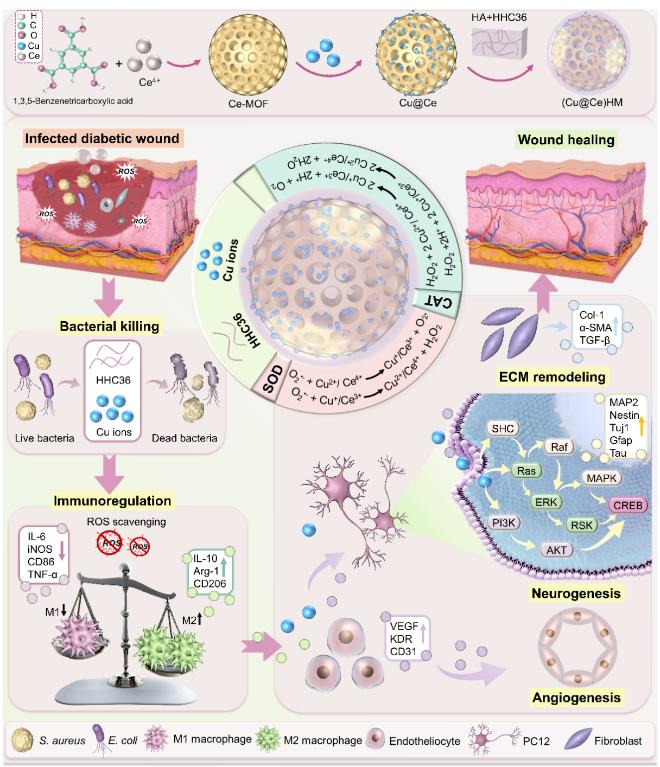
图1. (Cu@Ce)HM纳米颗粒制备过及其在糖尿病微环境中在抗菌、免疫调节、血管生成、神经生成和促进伤口愈合示意图。
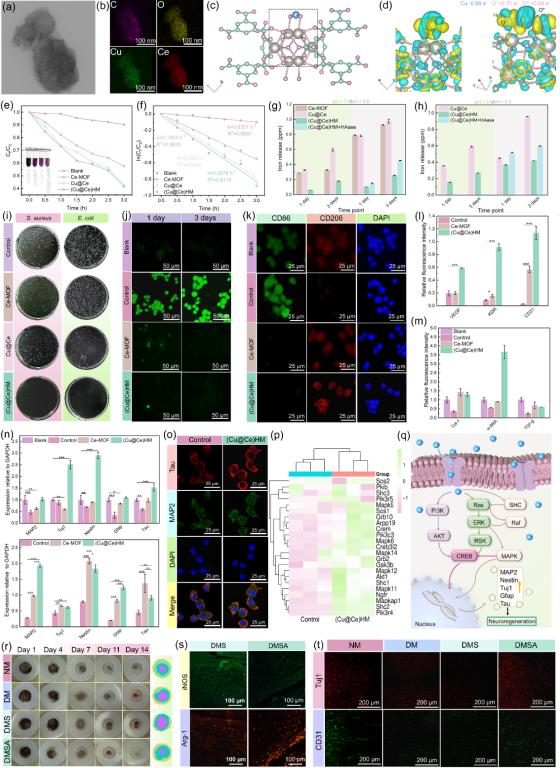
图2. (a) (b) (Cu@Ce)HM 纳米颗粒微观形貌及元素分布,(c) Ce-MOF-808结构示意图,(d) 不同角度下,Cu键合Ce-MOF电荷密度分布,(e) DPPH随时间降解曲线和代表性图像,(f) DPPH 的拟合动力学曲线以及一级速率常数,(g) (h) pH = 7.4/5.8下,Ce离子和Cu离子在1,3天的释放量,(i) Ce-MOF, Cu@Ce及(Cu@Ce)HM纳米课题的典型菌落图像,(j) (k) 巨噬细胞(RAW264.7)不同条件处理后的ROS染色及促炎因子(CD86)和抑炎因子(CD206)荧光染色的代表性图像,(l) 不同样品处理损伤巨噬细胞条件培养基培养内皮细胞(HUVEC)细胞功能因子表达,(m) 不同样品处理成纤维细胞(L929)功能因子表达,(n)不同样品处理损伤神经细胞(PC12)分化因子表达,(o) 与H2O2损伤对照组(Control)和(Cu@Ce)HM组分化相关因子Tau/MAP荧光染色代表性图像,(p) (Cu@Ce)HM与Control组之间神经分化基因表达水平相对变热图,(q) (Cu@Ce)HM 促进神经分化分子机制示意图,(r) 不同处理条件/时间点糖尿病感染伤口代表性图像,(s) 术后4天细菌感染糖尿病伤口有(DMSA)/无(DMS)(Cu@Ce)HM处理组促炎因子(iNOS)和抑炎因子(Arg-1)荧光染色代表性图像,(t)术后14天不同处理条件下伤口处神经(Tuj1)/血管(CD31)因子表达的代表性图像。
熟女俱乐部
张兰教授和憨勇教授为本论文的共同通讯作者,熟女俱乐部
博士生解慧慧为本论文的第一作者。该研究得到了国家自然科学基金委面上项目、陕西省自然科学基础研究计划项目杰出青年基金、重点基金、金属材料强度全国重点实验室开放课题的支持。
论文链接://doi.org/10.1016/j.biomaterials.2025.123771
张兰教授个人主页://gr.shunvjulebu.com/en/web/lan.zhang
憨勇教授个人主页://gr.shunvjulebu.com/web/yonghan